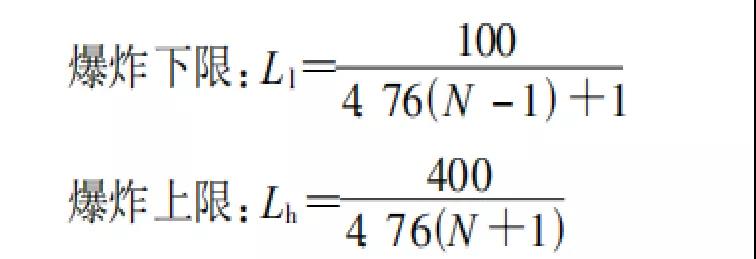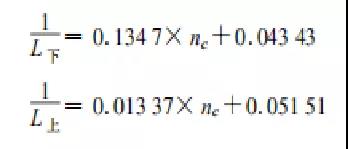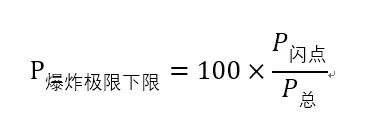路路君
前言
對一些物質的爆炸極限進行估算。
閃點:在規定的試驗條件下,可燃性液體或固體表面產生的蒸氣與空氣形成的海合物,遇火源能夠閃燃的液體或固體的最低溫度(采用閉杯法測定)。
爆炸極限:可燃的蒸氣、氣體或粉塵與空氣組成的混合物遇火源即能發生爆炸的濃度。(可燃氣體或蒸汽爆炸極限是以可燃性物質在混合物中所占體積的百分比(%)來表示)UEL:爆炸上限
參考資料:工業混合氣體爆炸極限預測的相關文獻
一、爆炸極限的估算
1 單組分可燃氣體爆炸極限
1.1 按化學計量比體積分數


該公式適用范圍:適用于鏈烷烴碳氫化合物爆炸極限的估算。
1.2按完全燃燒反應所需的氧原子數
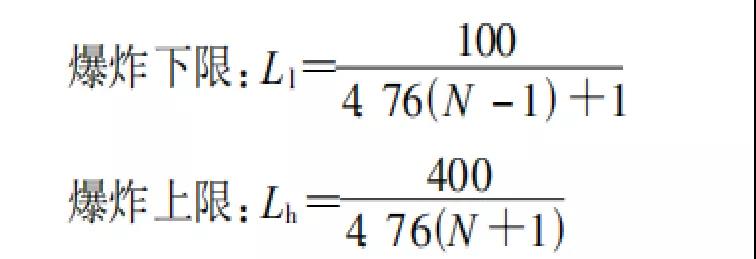
適用范圍:一般只適用于烷烴碳氫化合物爆炸極限的估算,不適用于H2、CO氣體的計算。N大于等于4。
1.3根據碳原子數計算
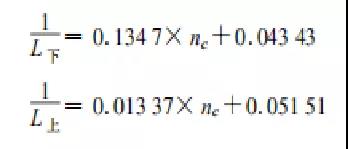
2 多組分可燃氣體爆炸極限
這里多組分可燃氣體指的所有組分均為可燃氣體,不含氧氣和惰性氣體。有兩個公式實際上,我感覺是一樣的。
2.1 萊·夏特爾定律

2.2 Le Chatelier 經驗方程

3 含有惰性氣體的可燃氣體爆炸極限

但是該公式未考慮不同惰性氣體(N2、CO2、H2O)對不同可燃氣體抑制效果,因此計算誤差較大。
4 一般混合物爆炸極限
4.1 全比例分配法
一般空氣中可近似看做20.9%氧氣和79.1%氮氣。氮:氧≈3.78。(1)將混合物分為可燃氣體、惰性氣體、氧氣三部分。扣除氧氣,以及對應空氣中的氮氣含量。重新算出各個組分的濃度。例:扣除1分子的氧,就扣除3.78分子氮,剩下的就是可燃氣體與惰性氣體混合物。(2)將每種惰性氣體和每種氣體分別組合,分別算出不同體積百分數 ,和相對性應爆炸極限。

例:假設3種可燃氣體(H2、CH4、CO)和兩種惰性氣體(N2、CO2),根據上面的公式可以算出,下列結果。
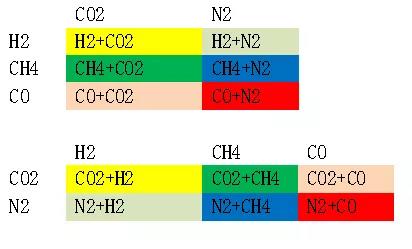
可以將CO2+H2視為一種新的可燃氣體:其體積分數就是上圖中黃色的數值之和,根據查表得到爆炸極限。其余組合相同,得到所有可燃氣體與惰性氣體分配方案。(3)根據Le Chatelier 經驗方程算出新的爆炸極限。(4)再將第一步去掉的氧氮空氣組合成新的爆炸上下限。(計算公式見4.2)
這種計算方法依賴于計算機,各種惰性氣體抑制系數也不好查,人工計算比較麻煩。
4.2 第二種估算法
(2)將惰性氣體組分扣除,算出不同可燃氣體組分的濃度。(3)根據Le Chatelier 經驗方程算出新的爆炸極限Lm。(4)將混合氣體視為為可燃氣體a、惰性氣體b、空氣c
新的爆炸極限L=Lm*a/ (a+c)
二、閃點與爆炸極限的關系
地址如下:http://blog.sciencenet.cn/blog-1213210-1175229.html閃點定義為溶劑蒸氣能夠發生閃燃的最低溫度,也就是說,在更低一點的溫度上,蒸汽濃度下降已經不能夠支持燃燒了。在這個溫度之上,能夠發生燃燒,火焰擴散之后,大量熱產生,如果在封閉空間內就可以引起爆炸。在閃點這個溫度下的蒸氣濃度,也就是蒸汽能夠爆炸的最低濃度了。開杯閃點測定時,由于有蒸氣的擴散過程,液體表面的蒸氣濃度往往不是飽和濃度,也就是說,要比閉杯條件同一溫度下的濃度要低一點。為了達到閃燃的最低濃度,這一溫度往往比閉杯情況下要稍高一點。根據上面的描述,應該是閉杯的閃點下蒸氣濃度更接近爆炸極根下限。有以下公式:
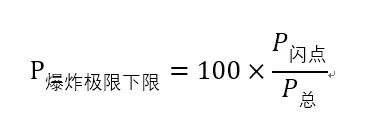
查乙醇閃點13℃,爆炸下限:3.3%。根據安托因方程,估算其閃點溫度下飽和蒸氣壓為:3.78kPa。計算其爆炸極限為:3.74%。查乙酸乙酯閃點-4℃,爆炸下限:2.0%。根據安托因方程,估算其閃點溫度下飽和蒸氣壓為:2.48kPa。計算其爆炸極限為:2.45%。
三、總結
常見的物性,我們可以通過文獻資料查到其物爆炸極限。對于一些不常見的物質,我們可以通過以上方法估算。